Das Schwein als Modellsystem für Duchenne Muskeldystrophie
Viele genetisch bedingte Krankheiten treten auch bei Tieren auf. Bevor man mit Therapien und Medikamenten am Menschen experimentiert, müssen Wirksamkeit und Sicherheit im Tierversuch getestet werden. Dazu werden oft „Krankheitsmodelle“ in Mäusen, Ratten hergestellt, indem man gezielt die gleichen Mutationen einführt, die auch beim Menschen auftreten.
Schweine als Krankheitsmodelle sind viel aufwändiger als Mäuse oder Ratten, in vielen Fällen aber auch viel aussagekräftiger. Warum das so ist und welche medizinischen Fortschritte mit Schweinemodellen erreicht werden, erklären wir hier am Beispiel der Duchenne Muskeldystrophie.
Muskeldystrophie
Die Duchenne-Muskeldystrophie (DMD) ist eine genetisch bedingte Krankheit, die durch Muskelschwund zu schweren Einschränkungen und einem frühen Tod führt. Für die Krankheit verantwortlich sind Mutationen im Dystrophin-Gen, das auf dem X-Chromosom liegt. Deshalb sind fast nur Männer von Muskeldystrophie betroffen. Bei Frauen wird das defekte Gen in der Regel von einem funktionsfähigen Dystrophin-Gen auf dem zweiten X-Chromosom kompensiert und es treten keine oder nur milde Krankheitssymptome auf.
Das Dystrophin-Gen ist mit über 2 Millionen Basenpaaren eines der größten Gene im menschlichen Genom (zum Vergleich: ein Aktin-Gen hat im Menschen nur ca. 3.000 Basenpaare).
Alleine durch seine Größe kann das Dystrophin-Gen an vielen verschiedenen Stellen mutieren – oft mit fatalen Konsequenzen. Eine universelle Gentherapie ist schon deshalb schwierig, weil Patienten viele unterschiedliche Mutationen haben können.
Viele der bekannten Mutationen führen zu einer Leserasterverschiebung (Frame-shift).

Schneidet man das ganze Wort „bunte“ aus, egal ob mit einem verloren, zusätzlichen oder falschen Buchstaben, geht zwar etwas Information verloren, der Satz bleibt aber lesbar. Die Methode, Teile eines Gens auszuschneiden oder bei der Übersetzung ins Protein zu überspringen, bezeichnet man als „Exon-Skipping“.
Ähnlich wie in der Abbildung gezeigt, kann man beim Dystrophin-Gen manche Teile über sogenanntes „Exon-Skipping“ entfernen, ohne die Funktion wesentlich zu stören. Wenn man das mit CRISPR-Cas präzise tut, ohne das Leseraster zu verändern, könnte man damit verschieden Mutationen in diesem Abschnitt unschädlich gemacht werden.
Modellsysteme
Wie weiss man, ob eine solche Therapie funktionieren kann? Sicher wird das zuerst in Zellkulturen getestet, aber irgendwann muss man in ein tierisches Modellsystem gehen, bevor man es beim Menschen versucht.
Ein klassisches Modellsystem ist die Maus. Sie ist leicht im Labor zu halten und man kann viele menschliche Krankheiten im Mausmodell nachstellen. Mäuse haben auch ein Dystrophin-Gen und so hat man gentechnisch Mäuse mit Muskeldystrophie hergestellt. Diese Tiere zeigten jedoch kaum Krankheitssymptome. Das war nicht so sehr überraschend: dieselbe Mutation kann, muss aber nicht in der Maus dieselben Effekte haben wie im Menschen. Eine Maus ist dem Menschen in vielen, aber gewiss nicht in allen Eigenschaften ähnlich. Ein Tiermodell ohne deutliche Krankheitssymptome ist aber nicht gut geeignet, um eine Therapie zu testen.
Mäuse sind klein und die absolute Muskelbelastung ist gering. Wir wissen, dass wir Muskeln durch Training aufbauen können. Aber auch ohne Fitness-Studio belasten wir unsere Muskulatur alleine dadurch, dass wir unser Körpergewicht herumtragen. Wachstum und Entwicklung von Muskeln hängt von der Belastung ab und dafür wird Dystrophin gebraucht. Tatsächlich zeigten die mutierten Mäuse etwas stärkere Dystrophie-Symptome, wenn sie ein Muskeltraining absolvieren mussten. Das war jedoch als Testsystem nicht ausreichend. Es musste also ein größeres, schwereres Modellsystem her und dafür eignet sich das Schwein.
An der Ludwig-Maximilians Universität in München wurden durch gezielte Mutation im Dystrophin-Gen Schweine gezüchtet, die tatsächlich sehr ähnliche Symptome wie menschliche DMD Patienten aufweisen. An diesen Tieren kann man nun verschiedene Therapien testen.

Wie geht man dabei vor?
Mit embryonalen Stammzellen oder iPS (induzierte pluripotente Stammzellen) aus Schweinen kann man eine Zellkultur anlegen, in der die Zellen unbegrenzt wachsen und für gentechnische Eingriffe zur Verfügung stehen.
In diesen Zellen wird mit CRISPR-Cas eine Mutation im Dystrophin-Gen eingeführt, die einer Mutation in menschlichen Patienten entspricht. Diese Zellen können molekularbiologisch analysiert werden um zu prüfen, ob die Genomeditierung wie beabsichtigt stattgefunden hat und keine Off-Target-Effekte eingetreten sind.
Dann werden reife Eizellen aus einer Sau entnommen. Der Zellkern wird unter dem Mikroskop mit einem Mikromanipulator entfernt und durch einen Kern aus der Zellkultur ersetzt.
Die Eizelle wird dann in die Gebärmutter einer Sau implantiert und führt zur Geburt von transgenen DMD-Ferkeln. Diese Tiere sind dann für Tests von Therapeutika gegen DMD geeignet.
Die Ferkel könnten auch später zur weiteren Zucht verwendet werden. Es ist jedoch schneller und einfacher, geclonte Tiere nach Kerntransfer zu verwenden. Zudem sind DMD-Schweine gesundheitlich beeinträchtigt, werden nicht sehr alt und sind deshalb für eine Zucht nicht gut geeignet.
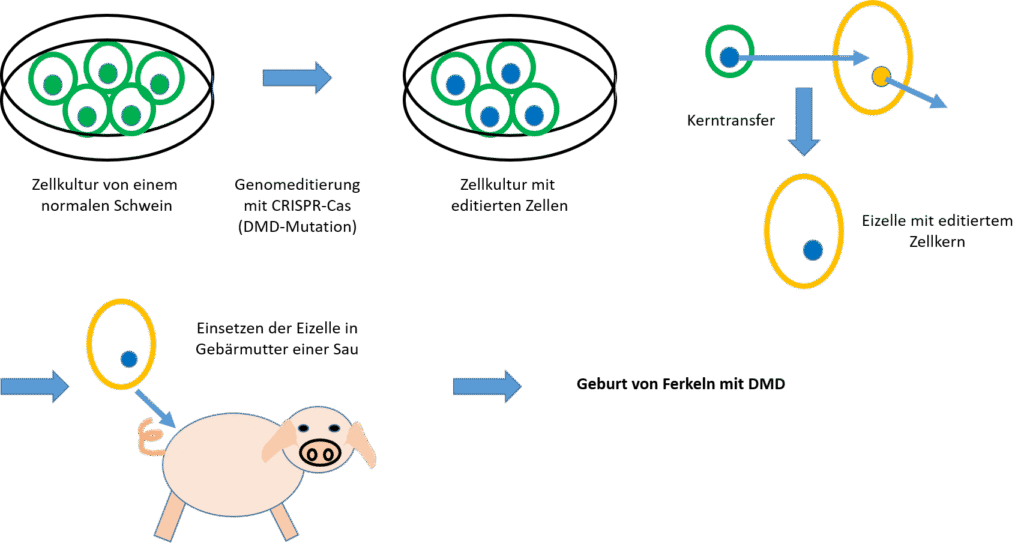
(Grafik: BioWissKomm)
Wie kriegt man ein CRISPR-Therapeutikum in die Muskeln?
An der LMU versuchte man es mit dem Exon-Skipping“, d.h. mit CRISPR-Cas wurden mutierte DNA-Sequenzen ausgeschnitten, die zu einer Leserasterverschiebung führten. In Zellkulturexperimenten war das erfolgreich: Zellen produzierten ein etwas kleineres, aber funktionsfähiges Dystrophin-Protein.
Die somatische Gentherapie, d.h. die Behandlung eines fertig entwickelten Tieres oder eines Menschen ist eine Herausforderung! Wie erreicht man mit dem CRISPR-Therapeutikum das gewünschte Gewebe/Organ (hier möglichst alle Muskeln)?
In der ersten bekannten CRISPR Therapie war das relativ „einfach“: es ging um eine Blutkrankheit (Sichelzellkrankheit). Blut-Stammzellen wurden aus dem Knochenmark der Patienten isoliert, in einer Zellkultur vermehrt und mit CRISPR-Cas behandelt . Anschließend wurden sie wieder in den Patienten implantiert. Bei Muskeln ist das nicht so einfach.
Im Labor von Prof. Eckhard Wolf an der Ludwig-Maximilians Universität in München setzte man auf einen „Rundumschlag“: wenn das CRISPR-Medikament in die Blutbahn infundiert wird, sollte es alle Zellen des Organismus erreichen können. Dazu werden die „Genschere“ Cas9 und die entsprechenden CRISPR-RNAs in AAV-Partikel verpackt. AAV (adeno associated virus) ist ein Virus, das für sich allein nicht krankheitserregend wirkt, bei mehrfachem Einsatz allerdings eine Immunreaktion auslösen kann.
Ob man damit allerdings genügend Muskelzellen erreicht und „heilen“ kann, um die Krankheitssymptome zu lindern, muss im Tierexperiment untersucht werden, bevor man sich an menschliche Patienten wagt.
Die ersten Versuche mit der Infusion bei DMD-Schweinen waren erfolgreich: es waren deutlich messbare Verbesserungen in der Muskelfunktion zu beobachten. Man schätzt, dass es ausreicht, 30% der Muskelzellen mit der Geneditierung zu erreichen, um zumindest eine Linderung der Krankheit zu bewirken.
Diese ersten Ergebnisse sind äußerst vielversprechend – aber es sind „nur“ erste Ergebnisse! Es wird weitere Versuche zum „Fine-Tuning“ geben müssen: man wird die Dosierung variieren, die Verpackung modifizieren und Langzeiteffekte untersuchen. Von einer Routinebehandlung menschlicher Patienten sind wir noch ein gutes Stück entfernt, aber wenn alles gut geht, sind erste Pilotbehandlungen am Menschen in absehbarer Zeit denkbar. Verschiedene andere Therapien die zur Heilung oder Linderung von Muskeldystrophie in präklinischen Studien erprobt werden, sind hier zusammengefasst.
Bei allen sind gute Tiermodelle unerlässlich.
Ethische Überlegungen
Natürlich sind DMD-Schweine gesundheitlich beeinträchtigt – sonst könnte man sie nicht als Krankheitsmodell verwenden. Tierversuche unterliegen strengen Vorschriften und einer strengen Begutachtung. Die Zahl der verwendeten Tiere muss auf ein Minimum beschränkt werden, das gerade ausreicht, um statistisch signifikante Ergebnisse zu erzielen. Aber auch aus rein ökonomischen Gründen werden Wissenschaftler nach sorgfältig ausgearbeiteten Programmen arbeiten und nicht einfach „rumexperimentieren“: die Tiere wurden aufwändig gezüchtet und sind sehr wertvoll. Das zeigt sich auch an der Tierhaltung bei der es wichtig ist, dass es den Tieren gut geht. Die tägliche Protokollierung des Gesundheitszustands ist selbstverständlich und dabei werden auch kleinste Unregelmäßigkeiten wie eine erhöhte Temperatur oder geringere Nahrungsaufnahme aufgezeichnet.
Sind solche Tierversuche gerechtfertigt?
Wenn man Familien befragt, in denen es DMD Patienten gibt, wird die Antwort eindeutig „ja“ sein. In der übrigen Bevölkerung mag es unterschiedliche Meinungen geben. Auf jeden Fall sind Schweine, die wir täglich auch als Nahrungsmittel verwenden, in der Öffentlichkeit eher akzeptabel als Hunde (von denen es auch ein seltener verwendetes DMD-Modell gibt) und Affen, die dem Menschen näher stehen und bei denen stärkere ethische Bedenken bestehen.
Ein häufiges Argument, dass Tierversuche durch Zellkulturen, Organoide oder Computersimulationen ersetzt werden können, gilt hier, wie oben erläutert, nicht.
Autor: Wolfgang Nellen, BioWissKomm
Abbildungen: Grafiken und Fotos von BioWissKomm. Titelbild (Mann im Rollstuhl) mit Midjourney erstellt

