Nobelpreis für Katalin Kariko und Drew Weissmann: mehr als nur ein COVID-19 Impfstoff.
Katalin Kariko und Drew Weissmann haben den Nobelpreis 2023 für „Physiologie oder Medizin“ erhalten. Er würdigt ihren essentiellen Beitrag zur Entwicklung von RNA-basierten Impfstoffen.
Anmerkungen vorab
Der Nobelpreis ist mit knapp 1 Mio Euro dotiert – zweifellos eine Menge Geld und vor allem eine große Ehre. Gute Fußballspieler verdienen das 50 bis 200fache (pro Jahr).
Katalin Kariko hatte eine Assistenzprofessur an der medizinischen Fakultät der University of Pennsylvania (USA), wurde aber dann auf eine befristete Posdoc-Stelle mit geringerem Gehalt degradiert, weil sie „nicht die erforderlichen Qualitäten für eine Professur“ und ihre Forschung keine besondere Relevanz habe. Das Patent, das sie zusammen mit Drew Weissmann angemeldet hatte, wurde von der Universität verkauft. Auch renommierte Universitäten können gravierende Fehlentscheidungen treffen!
Das Nobel-Komitee begründet die diesjährige Auszeichnung damit, dass Kariko und Weissmann einen wesentlichen Beitrag zur Entwicklung von COVID-19 Impfstoffen geleistet haben. Das stimmt zwar, war aber eher ein „Nebenprodukt“ – die Bedeutung der Arbeit geht sehr weit darüber hinaus. Eine Vielzahl von Anwendungen ist heute noch nicht einmal absehbar. Es ist etwas schade, dass das nicht deutlicher betont wird!
Ich durfte 2021 Katalin Kariko auf der 1E9 Konferenz in München kennenlernen. Die „starrköpfige“ Wissenschaftlerin hat mich mit ihrer bescheidenen Art und ihren spannenden Geschichten beeindruckt. Mit einem kleinen Grinsen sagt sie, dass sie jetzt mehr Medaillen als ihre Tochter Susan hat (die hat zwei olympische Goldmedaillen) und dass einige ihrer Medaillen (im Gegensatz zum olympischen Gold) aus echtem Gold sind! Und dann „Ich habe jetzt genug Medaillen, die nächsten können sie ruhig mal den anderen geben!“. Über den Nobelpreis hat sie sich dann aber wohl doch gefreut.

Ein wissenschaftliches Problem und wie man es durch Hartnäckigkeit lösen kann.
Seit mehr als 30 Jahren gibt es die Idee, mRNA direkt in einen Organismus zu injizieren, um ein bestimmtes Protein zu produzieren. Erste Experimente wurden bereits 1990 durchgeführt. Sie zeigten, dass das Konzept grundsätzlich funktionierte, dabei aber drei Probleme auftraten, die lange Zeit nicht gelöst werden konnten:
- Wie bekommt man die mRNA effektiv in eine Zelle?
- Wie verhindert oder reduziert man die angeborene Immunitätsreaktion (inate immunity) gegen RNA?
- Wie kann man die an sich sehr instabile RNA ausreichend lange stabil erhalten?
Das erste Problem wurde schon relativ früh durch eine Verpackung in „Fett-Tröpfchen“ (lipid vesicles) gelöst. Die Technik wurde im Laufe der Jahre perfektioniert und man konnte „lipid nano particles“ (LNP) herstellen, die aus verschiedenen definierten Fettsäuren in bestimmten Verhältnissen zusammengesetzt waren.
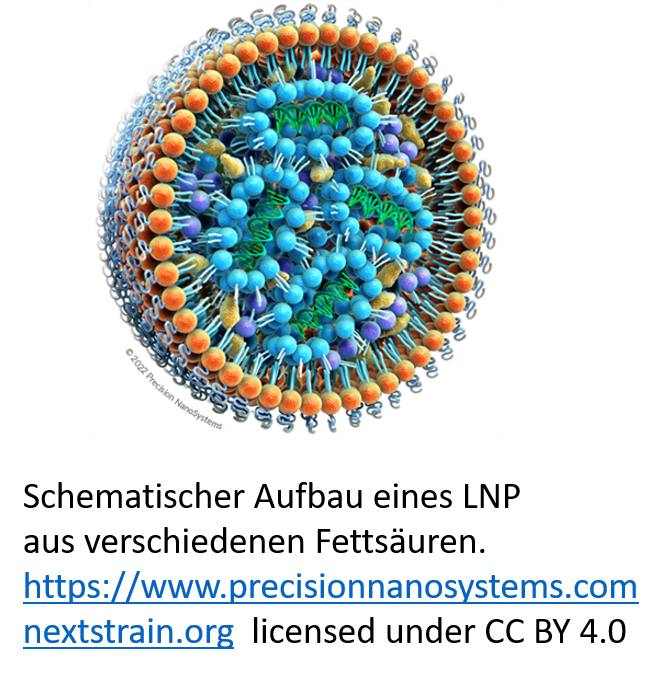
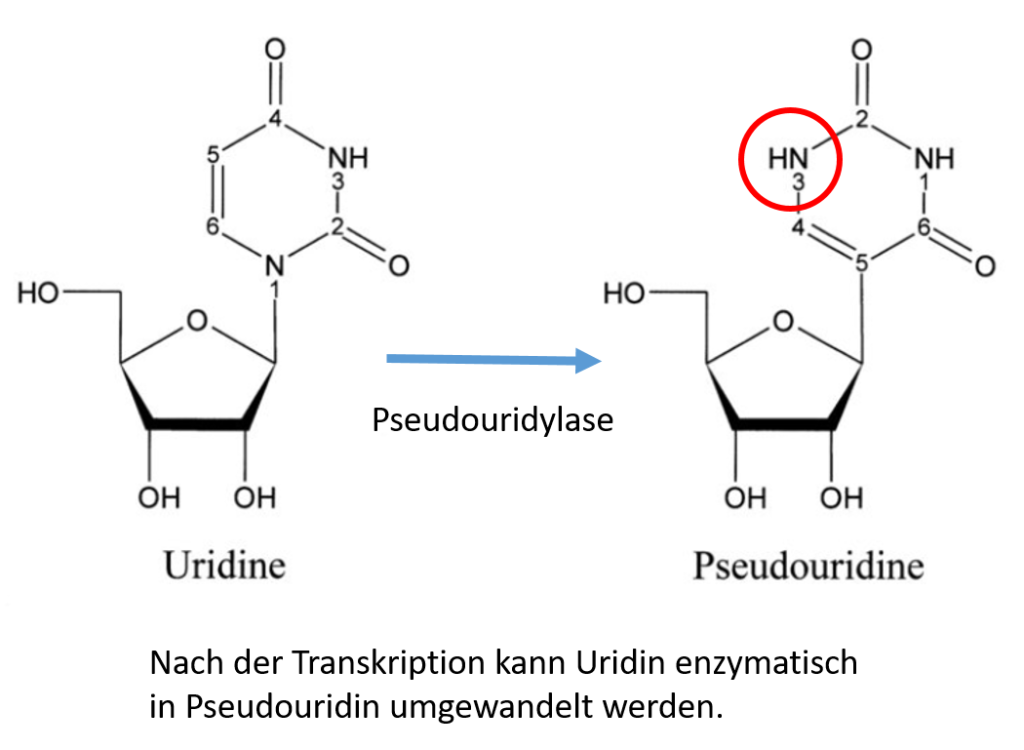
2018 wurde die erste RNA, in LNP verpackt, als Therapeutikum zugelassen. Dabei handelte es sich um eine sehr kurze siRNA, die nicht für ein Protein codierte, sondern eine regulatorische Funktion hatte. Deshalb gab es keine wesentlichen Probleme mit der angeborenen Immunität und der Stabilität. Problem 2 und 3 wurden von Kariko und Weissmann in einem Schritt gelöst. Es war bekannt, dass verschieden natürliche RNAs (z.B. tRNA und rRNA) in praktisch allen Organismen modifizierte Nukleotide enthielten, die die Erkennung der RNA durch einen Rezeptor (TLR) unterdrücken. Damit wurde die Immunreaktion auf die eingeführte RNA praktisch ausgeschaltet.
Wenn man in einer mRNA die Base Uridin durch die natürlich vorkommende Variante Pseudouridin ersetzte, reichte das bereits aus.
Versuche mit entsprechenden synthetischen mRNAs, zeigten, dass in Versuchstieren nicht nur die Immunantwort unterdrückt wurde, auch die Stabilität der mRNA war deutlich höher und sogar die Translation, die Übersetzung in das Protein, war besser.
Was bringt das in der Praxis?
Die Herstellung beliebiger mRNAs ist mit den modernen Synthesizern kein Problem mehr. Dabei können auch beliebige modifizierte Nukleotide eingebaut werden.
Damit war ein wesentlicher Schritt zur Produktion mRNA basierter Impfstoffe getan: anstatt aufwändig abgeschwächte oder abgetötete Pathogene (wie z.B. Viren) zu entwickeln und zur Immunisierung zu spritzen, konnte die Bauanleitung für virale Oberflächenproteine verabreicht werden. Der Impfschutz war der gleiche (oder sogar besser), man konnte ihn sehr schnell an Virusmutanten anpassen und das Risiko, doch mit abgeschwächten Viren infiziert zu werden, war deutlich geringer.
Aber es wird nicht bei einer Alternative für herkömmliche Impfstoffen bleiben. Krebszellen tragen bestimmte Merkmale auf ihrer Oberfläche, die aber meist dem Immunsystem entgehen. Diese Oberflächenantigene zu identifizieren und dem Immunsystem als großen „Steckbrief“ zu präsentieren, verspricht gute Krebstherapien, an denen intensiv gearbeitet wird.
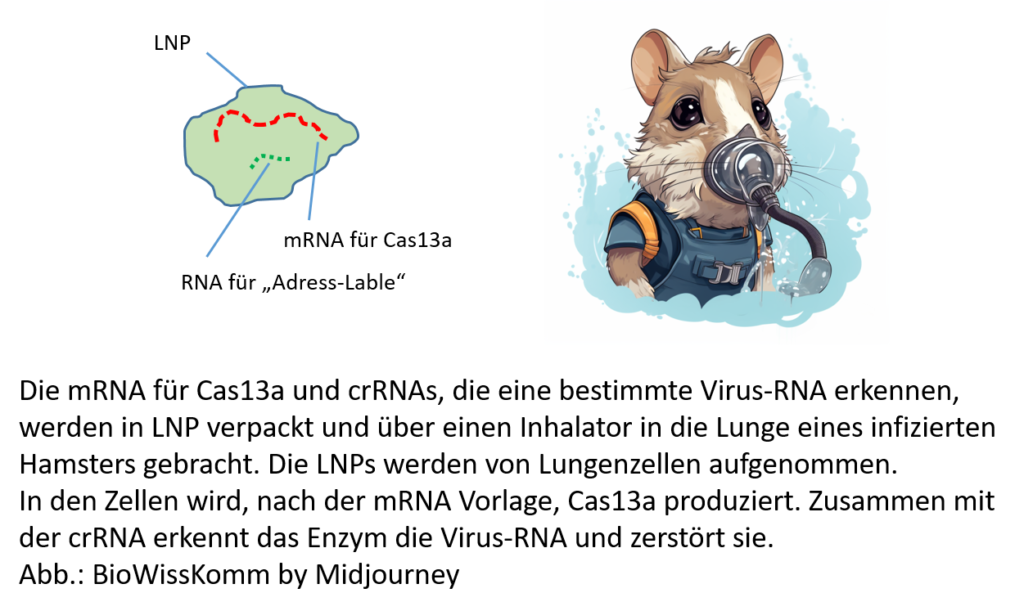
Eine weitere geniale Idee ist es, die mRNA Technologie mit der CRISPR-Cas Methode zu kombinieren.
Dazu wird die mRNA für die „Genschere“ Cas13 in ein LNP verpackt. Cas13 kann (im Gegensatz zu Cas9) RNA zerschneiden. Zusätzlich werden in das LNP Leit-RNAs (crRNAs) verpackt, die virale RNA erkennen. Über einen Inhalator wurden die beladenen LNP als Aerosol in die infizierte Lunge eines Hamsters gebracht. In den Lungenzellen wird Cas13 synthetisiert und zerschneidet gezielt die Virus-RNA. Damit ist der Infektionszyklus gestoppt. Dabei handelt es sich also nicht um eine Impfung mit Immunisierung, sondern um eine direkte Therapie, die eine Virusinfektion ausschaltet.
Das sind keine Arbeiten von Kariko und Weissmann – aber sie haben die Grundlagen dafür gelegt.
Das Besondere an der Sache: man braucht vielleicht ein paar Tage um, z.B. für einen Impfstoff, eine gute mRNA am Computer zu entwerfen, sie auf dem Synthesizer herzustellen und erste Tests durchzuführen. Die erforderlichen klinischen Studien brauchen länger, trotzdem geht alles wesentlich schneller als bei herkömmlichen Impfstoffen. In großen Mengen wird die mRNA dann in zellfreien biologischen Systemen hergestellt. Dazu verwendet man Extrakte aus Bakterien, die von einem synthetischen Gen (DNA) sehr viele Kopien (RNA) ablesen. Als Bausteine werden dazu die Ribonukleotide A, C, G und Psi (Pseudouridine) zugegeben.
Auch solche „RNA-Drucker“ gibt es inzwischen als vollautomatische Anlagen, die auch in Ländern,
die technologisch noch nicht so weit fortgeschritten sind, problemlos aufgestellt werden können. Das bedeutet, dass Impfstoffe und andere RNA-basierte Medikamente direkt dort hergestellt werden können, wo sie am dringendsten gebraucht werden.
Eine ausführlichere Beschreibung des Potenzials der mRNA-Technologie ist hier zu finden. Darin wird auch die alternative Methode der Impfstoffentwicklung der Firma CureVac erläutert, die bisher noch nicht zur Anwendung gekommen ist. Auch da geht es darum, die negativen Effekte von Uridine (Destabilisierung der RNA und Immunogenität) zu vermeiden – aber auf einem ganz anderen Weg.
Autor: W. Nellen
Titelbild: https://www.nobelprize.org/prizes/medicine/

